A kutatócsoport honlapja
Vezető
Róna Gergely, PhD
Általános kutatási terület
Kutatásaink középpontjában annak vizsgálata áll, hogy a sejtjeink miként őrzik meg a genomi integritásukat. Genetikai, biokémiai, sejtbiológiai és proteomikai módszerek használatával próbáljuk leírni azokat a molekuláris mechanizmusokat, ami bizonyos betegséget hátterében áll. Ezáltal új, innovatív terápiás megközelítési módszerekre igyekszünk javaslatokat tenni.
Főbb kutatási témák
A laboratóriumunk arra törekszik, hogy jobban megértse azokat az alapvető folyamatokat, amelyek fenntartják sejtjeinkben a genomi integritást. Figyelemre méltó, ahogy a genomunkban kódolt információ páratlan precizitással őrzött, ugyanakkor kellően rugalmas ahhoz, hogy alkalmazkodni tudjon a környezeti változásokhoz. A DNS-hibajavító folyamatok sejtjeink kulcsfontosságú folyamatai közé tartozik, mivel ezen a mechanizmusok hibás szabályozása, számos ráktípus és neurodegeneratív betegség hajtóereje. Célunk, új terápiás megközelítések megalapozása azáltal, hogy ezen betegségek mögött meghúzódó molekuláris mechanizmusokat feltárjuk. Munkánk során sejtbiológiai, genetikai, biokémiai és proteomikai módszerekre, valamint szerkezeti biológusokkal és egér genetikusokkal való együttműködésre támaszkodunk.
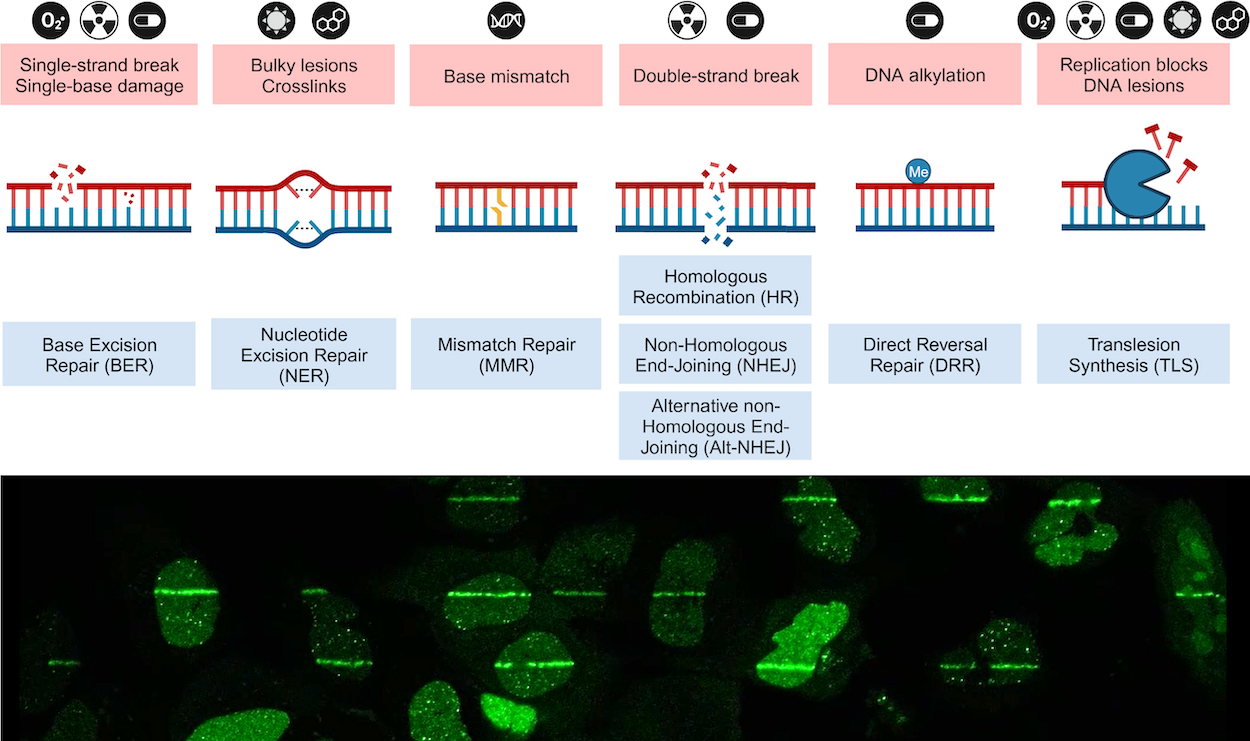
Neurális DNS javítás
Neurális DNS-hibajavítás molekuláris mechanizmusai.
A neurológiai rendellenességek a rokkantság és a halálozás egyik vezető oka világszerte, ami egyre nagyobb terhet ró az elöregedő európai társadalomra. Célunk, hogy jobban megértsük a DNS-hibajavítás mechanizmusinak hibáit neurodegeneratív betegségekben, és ezt a tudást felhasználva, ezen megbetegedések új sebezhetőségeit azonosítsuk. Az idegrendszer nagy energiaigénye, magas transzkripciós aktivitása és ezen sejtek hosszú élettartama miatt rendkívül érzékeny a stressz minden formájára, beleértve a DNS-károsodást is. A DNS-hibajavító gének mutációi számos neurológiai rendellenességgel és szomatikus tri/dinukleotid expanzióval járnak, ami kritikus szerepet játszik az olyan neurodegeneratív betegségek kialakulásában, mint például a Huntington-kór (HD) vagy az Amiotrófiás laterálszklerózis (ALS). A neuronok fiziológiás körülmények között képesek helyreállítani és megvédeni genomjukat a DNS-károsodás ellen, annak ellenére, hogy ezen sejtek nem replikálnak, ami egy fontos korlátozó tényező számos DNS-hibajavítási folyamat számára. Továbbra is kérdés azonban ezen DNA-hibajavítási folyamatok pontos molekuláris háttere, valamint az, hogy ezek a nem megújuló sejtek hogyan őrzik meg a genomi integritásukat sok évtizeden át.
Nukleáz inhibitorok terápiás hasznosulása
Inhibitor szűrés és fejlesztés.
Célunk kismolekulás inhibitorok azonosítása, olyan onkológiai szempontból releváns exonukleázokkal szemben, amik segíthetik a jelenleg elérhető terápiás megközelítési módszereket. Egy új, nagy áteresztőképességű aktivitási assay használatával célunk az immunoterápia területén releváns exonukleázok kismolekulájú inhibitorainak azonosítása és optimalizálása. Erőfeszítéseink mind a sugár-, mind a kemoterápiás kezeléseket hatékonyságát növelni fogják az IFN-függő daganatellenes immunitás elősegítésén keresztül.
Nem osztódó sejtek DNS-hibaelkerülő útvonalainak szerepe

Transzléziós szintézis szerepe differenciált sejtekben.
Minden sejtünknek naponta több tízezer DNS-hibával kell megbirkóznia. Ezeknek a hibáknak a javítást a DNS-hibajavító útvonalak egyike hajtja végre a DNS lézió pontos kémiai természetétől és a sejtciklus fázisától függően. A sejtek egy specifikus kihívással néznek szembe, amikor DNS lézióval találkoznak DNS-replikáció vagy a DNS-hibajavító szintézis (amely a DNS-hibajavítási folyamatok végső lépése) során. A replikatív DNS-polimerázok katalitikus helye kompakt, jól definiált, igy nem képes befogadni hibás bázist és ennek okán nem képes továbblépni, ha DNS hibába ütközik. Ennek következtében a DNS-replikáció a DNS-hibák legtöbb formájánál leáll. A sejtek egyik megoldása ilyen esetben, hogy a PCNA-n, a replikatív DNS-polimerázokat, transzléziós polimerázok fogják váltani, hogy megkerüljék ezeket a léziókat. Ezt a folyamatot transzléziós szintézisnek (TLS) nevezik. Míg a TLS polimerázok aktivációjáról és működéséről sok információnk van az S fázisban (replikáció alatt), de szinte alig ismert valami ezen polimerázok a funkciójukról nem osztódó sejtekben, vagy G1/G0 sejtciklus fázisokban. Munkánk során ezen kérdések megválaszolására törekszünk.
Fontosabb publikációk
Zhang, Q., Kerzhnerman, M. A., García-Vázquez, N., Rona, G. Visualizing Single-Stranded DNA Foci in the G1 Phase of the Cell Cycle. J. Vis. Exp (2023).
Rona, G., Zeke, A., Miwatani-Minter, B., de Vries, M., Kaur, R., Schinlever, A., Garcia, S. F., Goldberg, H. V., Wang, H., Hinds, T. R., Bailly, F., Zheng, N., Cotelle, P., Desmaele, D., Landau, N. R., Dittmann, M. & Pagano, M. The NSP14/NSP10 RNA repair complex as a Pan-coronavirus therapeutic target. Cell Death Differ 29, 285-292 (2022).
Simoneschi, D., Rona, G., Zhou, N., Jeong, Y. T., Jiang, S., Milletti, G., Arbini, A. A., O’Sullivan, A., Wang, A. A., Nithikasem, S., Keegan, S., Siu, Y., Cianfanelli, V., Maiani, E., Nazio, F., Cecconi, F., Boccalatte, F., Fenyo, D., Jones, D. R., Busino, L. & Pagano, M. CRL4(AMBRA1) is a master regulator of D-type cyclins. Nature 592, 789-793 (2021).
Miwatani-Minter, B. & Rona, G. Laser Micro-Irradiation to Study DNA Recruitment During S Phase. J Vis Exp (2021).
Maiani, E., Milletti, G., Nazio, F., Holdgaard, S. G., Bartkova, J., Rizza, S., Cianfanelli, V., Lorente, M., Simoneschi, D., Di Marco, M., D’Acunzo, P., Di Leo, L., Rasmussen, R., Montagna, C., Raciti, M., De Stefanis, C., Gabicagogeascoa, E., Rona, G., Salvador, N., Pupo, E., Merchut-Maya, J. M., Daniel, C. J., Carinci, M., Cesarini, V., O’Sullivan, A., Jeong, Y. T., Bordi, M., Russo, F., Campello, S., Gallo, A., Filomeni, G., Lanzetti, L., Sears, R. C., Hamerlik, P., Bartolazzi, A., Hynds, R. E., Pearce, D. R., Swanton, C., Pagano, M., Velasco, G., Papaleo, E., De Zio, D., Maya-Mendoza, A., Locatelli, F., Bartek, J. & Cecconi, F. AMBRA1 regulates cyclin D to guard S-phase entry and genomic integrity. Nature 592, 799-803 (2021).
Palinkas, H. L., Bekesi, A., Rona, G., Pongor, L., Papp, G., Tihanyi, G., Holub, E., Poti, A., Gemma, C., Ali, S., Morten, M. J., Rothenberg, E., Pagano, M., Szuts, D., Gyorffy, B. & Vertessy, B. G. Genome-wide alterations of uracil distribution patterns in human DNA upon chemotherapeutic treatments. Elife 9 (2020).
Rona, G., Roberti, D., Yin, Y., Pagan, J. K., Homer, H., Sassani, E., Zeke, A., Busino, L., Rothenberg, E. & Pagano, M. PARP1-dependent recruitment of the FBXL10-RNF68-RNF2 ubiquitin ligase to sites of DNA damage controls H2A.Z loading. Elife 7 (2018).
Rona, G., Scheer, I., Nagy, K., Palinkas, H. L., Tihanyi, G., Borsos, M., Bekesi, A. & Vertessy, B. G. Detection of uracil within DNA using a sensitive labeling method for in vitro and cellular applications. Nucleic Acids Res 44, e28 (2016).
Dankert, J. F., Rona, G., Clijsters, L., Geter, P., Skaar, J. R., Bermudez-Hernandez, K., Sassani, E., Fenyo, D., Ueberheide, B., Schneider, R. & Pagano, M. Cyclin F-Mediated Degradation of SLBP Limits H2A.X Accumulation and Apoptosis upon Genotoxic Stress in G2. Mol Cell 64, 507-519 (2016).
Rona, G., Borsos, M., Ellis, J. J., Mehdi, A. M., Christie, M., Kornyei, Z., Neubrandt, M., Toth, J., Bozoky, Z., Buday, L., Madarasz, E., Boden, M., Kobe, B. & Vertessy, B. G. Dynamics of re-constitution of the human nuclear proteome after cell division is regulated by NLS-adjacent phosphorylation. Cell Cycle 13, 3551-3564 (2014).
Muha, V., Horvath, A., Bekesi, A., Pukancsik, M., Hodoscsek, B., Merenyi, G., Rona, G., Batki, J., Kiss, I., Jankovics, F., Vilmos, P., Erdelyi, M. & Vertessy, B. G. Uracil-containing DNA in Drosophila: stability, stage-specific accumulation, and developmental involvement. PLoS Genet 8, e1002738 (2012).
Aktuális együttműködések:
Anna Pluciennik, Thomas Jefferson University, USA
Beata Vertessy, HUN-REN TTK, Hungary
Beatrix Ueberheide, New York University School of Medicine, USA
Bostjan Kobe, University of Queensland, Australia
David Fenyö, NYU Grossman School of Medicine, USA
Didier Desmaële, Institut Galien, Université Paris-Saclay, France
Eli Rothenberg, NYU Grossman School of Medicine, USA
Lorinc S. Pongor, Hungarian Centre of Excellence for Molecular Medicine, University of Szeged, Hungary
Manor Askenazi, Biomedical Hosting LLC, USA
Meike Dittmann, NYU Grossman School of Medicine, USA
Michele Pagano, NYU Grossman School of Medicine / HHMI, USA
Nathaniel R. Landau, NYU Grossman School of Medicine, USA
Ning Zheng, University of Washington / HHMI, USA
Philippe Cotelle, University of Lille, INSERM, France
Piotr Sicinski, Dana-Farber Cancer Institute, USA
Zachary D. Nagel, Harvard T.H. Chan School of Public Health, USA
Csoportkép (2024)